
发布于 2024-10-18 14:07:27
根据《中国药典》(2020版)第三部生物制品生产用原材料及辅料质量控制要求,生物制品是采用生物技术制备而成的具有活性的药品,其生产工艺复杂且易受多种因素影响;生产过程中使用的各种材料来源复杂,可能引入外源因子或毒性化学材料;制品组成成分复杂且一般不能进行终端灭菌,制品的质量控制仅靠成品检定难以保证其安全性和有效性。因此,对生物制品生产用原材料和辅料进行严格的质量控制,是降低制品中外源因子或有毒杂质污染风险,保证生物制品安全有效的必要措施。
一款合格得干细胞培养基,需要通过安全性、稳定性及有效性等多维度评测,主要包括但不限于培养基理化相关检测:pH、渗透压、可见异物等;安全性相关检测:无菌、内毒素、支原体,HBV、HCV、HIV、TP、HTLV、CMV的病毒检测,动物源成分BSA检测、染色体核型分析等;有效性相关检测:多向分化潜能、细胞生长曲线、免疫调节能力等检测项目。
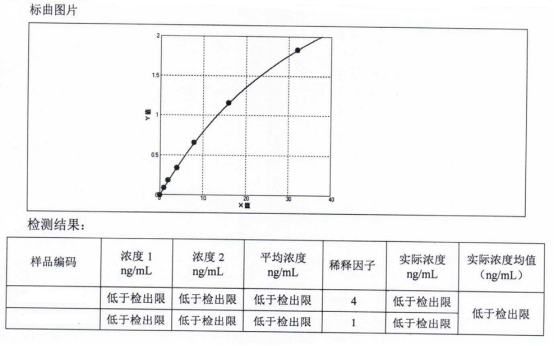
BSA残留
牛血清白蛋白(BSA)是FBS中的主要成分, 包含607个氨基酸残基,分子量为66.446KDa,等电点为4.7。虽然在生物制品的制备过程中经纯化可以去除大部分的BSA,但微量BSA依然会存在于生物制剂成品中。作为一种异源蛋白的代表,超过一定浓度的BSA能够引起机体的多种免疫反应,引起严重的副作用,从而影响生物制品的安全性。因此, 检测BSA的残留被作为国家对生物制品质量控制的重要指标。2020版《中国药典》第三部中,规定了大多数生物制品中对于BSA残留量的检测,且残留量应不高于50ng/mL(剂)。
BSA 残留检测方法种类繁多,各有优势,主要包括免疫扩散法、免疫电泳法、表面等离子共振法以及酶联免疫吸附测定法等。酶联免疫吸附测定法是将抗原或抗体结合在固相载体表面,利用抗原抗体的特异性结合以及抗体或者抗原上标记的酶催化特定底物发生显色反应,实现目标物检测的免疫分析方法。酶联免疫吸附法于1971年被ENGVALL首次提出,该技术是继免疫荧光、放射免疫技术之后,又重新建立的使用酶来标记抗原或抗体的检测技术。根据反应途径的不同,ELISA技术最常见的测定方法主要有直接测定法、间接测定法和双抗夹心法等,每种测定技术都有其优势和不足,需要根据具体检测的样本、用途等选择合适的方法。
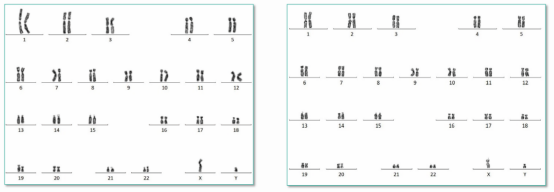
染色体核型分析
染色体是细胞分裂期高度凝集的DNA蛋白质纤维,是间期染色质结构紧密盘绕折叠的结果。核型是指一个细胞的染色体按其大小、形态特征排列起来构成的图像。染色体核型分析主要基于染色体在细胞分裂过程中的可见性,利用显微镜观察并记录染色体的数量、形态和结构特征。这些特征包括染色体的长度、着丝粒位置、臂比、随体大小等。通过对这些特征的统计分析,可以得出生物体的染色体核型,即染色体组成和特征的总和。染色体核型分析的关键步骤包括细胞培养、染色体显带技术、图像采集和处理等。细胞培养是为了获得足够数量的分裂中期细胞,以便进行显微观察。染色体显带技术则是通过特定的化学处理,使染色体呈现出明显的带纹,便于识别和区分不同的染色体。图像采集和处理则是利用显微镜和计算机图像处理技术,对染色体图像进行采集、增强和分析,提取染色体的数量、形态和结构特征,目前G显带(G Banding)染色体核型分析技术仍然是行业内的“金标准”。
用各种不同的方法.以及用不同的染料处理染色体标本后,使每条染色体上出现明暗相间或深浅不同带纹的技术,称为显带技术(banding technique》。20世纪70年代以来,显带技术得到了很大发展,且在众多的显带技术中(Q带、G带、C带、R带、T带)。G带是目前被广泛应用的一种带型。G带主要是被Giemsa染料染色后而显带,故称之为G显带技术,其所显示的带纹分布在整个染色体上。使用Giemsa染料对染色体进行染色,使染色体在显微镜下显示出深浅不同的带型,人类24种染色体可呈现出各自特异的带纹。该技术根据Giemsa的第一个字母命名。根据着丝粒的位置,人类染色体可以分为三种:中央着丝粒染色体,着丝粒位于或靠近染色体中央,将染色体分为长短相近的两个臂;亚中着丝染色体,着丝粒偏于一端,将染色体分为长短明显不同的两个臂;近端着丝染色体,着丝粒靠近一端。
声明
1.本文旨在分享科普知识,进行学术交流,或传递行业前沿进展,不作为官方立场,不构成任何价值判断,不作为相关医疗指导或用药建议,无任何广告目的,非进行产品贩卖,仅供读者参考。
2.本账号转载的图文视频等内容若涉及版权等问题,请联系我们及时处理删除。